Dari Wikipedia bahasa Indonesia, ensiklopedia bebas

Kimia (serapan dari Arab: كيمياء) adalah cabang dari ilmu fisik yang mempelajari tentang susunan, struktur, sifat, dan perubahan materi.[1][2] Ilmu kimia meliputi topik-topik seperti sifat-sifat atom, cara atom membentuk ikatan kimia untuk menghasilkan senyawa kimia, interaksi zat-zat melalui gaya antarmolekul yang menghasilkan sifat-sifat umum dari materi, dan interaksi antar zat melalui reaksi kimia untuk membentuk zat-zat yang berbeda.
Kimia kadang-kadang disebut sebagai ilmu pengetahuan pusat karena menjembatani ilmu-ilmu pengetahuan alam, termasuk fisika, geologi, dan biologi.[3][4][5]
Para ahli berbeda pendapat mengenai etimologi dari kata kimia. Sejarah kimia dapat ditelusuri kembali sampai pada alkimia, yang sudah dipraktikkan selama beberapa milenia di berbagai belahan dunia.
Etimologi[sunting | sunting sumber]

Kata kimia berasal dari alkimia, sebutan untuk serangkaian praktik pada masa-masa terdahulu yang meliputi unsur-unsur ilmu kimia, metalurgi, filsafat, astrologi, ilmu mistik, dan ilmu pengobatan. Alkimia sering kali dianggap berhubungan dengan usaha mengubah timbal atau bahan-bahan baku biasa lainnya menjadi emas,[6] tetapi pada zaman kuno ilmu ini mengkaji banyak pokok persoalan ilmu kimia modern. Alkimia didefinisikan oleh alkemis Yunani-Mesir awal abad ke-4 M, Zosimos, sebagai ilmu yang mempelajari tentang komposisi air, pergerakan, pertumbuhan, mewujud, menghilang, mengeluarkan roh dari raga, dan mengikat roh di dalam raga.[7]
Kata alkimia berasal dari kata Arab al-kīmīā (الکیمیاء). Kata al-kīmīā diturunkan dari kata Yunani χημία (kemia) atau χημεία (kemeia).[8][9] Al-kīmīā boleh jadi berasal dari Mesir Kuno karena kata al-kīmīā mungkin diturunkan dari kata Yunani χημία (kemia), yang juga diturunkan dari kata Kemi atau Kimi, yakni nama kuno negeri Mesir dalam bahasa Mesir.[8] Mungkin pula, kata al-kīmīā diturunkan dari kata χημεία (kemeia), yang berarti “dituang bersama-sama” (ke dalam cetakan).[10]
Pengantar[sunting | sunting sumber]
Kimia sering disebut sebagai “ilmu pusat” karena menghubungkan berbagai ilmu lain, seperti fisika, ilmu bahan, nanoteknologi, biologi, farmasi, kedokteran, bioinformatika, dan geologi.[11] Koneksi ini timbul melalui berbagai subdisiplin yang memanfaatkan konsep-konsep dari berbagai disiplin ilmu. Sebagai contoh, kimia fisik melibatkan penerapan prinsip-prinsip fisika terhadap materi pada tingkat atom dan molekul.
Kimia berhubungan dengan interaksi materi yang dapat melibatkan dua zat atau antara materi dan energi, terutama dalam hubungannya dengan hukum pertama termodinamika. Kimia tradisional melibatkan interaksi antara zat kimia dalam reaksi kimia, yang mengubah satu atau lebih zat menjadi satu atau lebih zat lain. Kadang reaksi ini digerakkan oleh pertimbangan entalpi, seperti ketika dua zat berentalpi tinggi seperti hidrogen dan oksigen elemental bereaksi membentuk air, zat dengan entalpi lebih rendah. Reaksi kimia dapat difasilitasi dengan suatu katalis, yang umumnya merupakan zat kimia lain yang terlibat dalam media reaksi tetapi tidak dikonsumsi (contohnya adalah asam sulfat yang mengkatalisasi elektrolisis air) atau fenomena immaterial (seperti radiasi elektromagnet dalam reaksi fotokimia). Kimia tradisional juga menangani analisis zat kimia, baik di dalam maupun di luar suatu reaksi, seperti dalam spektroskopi.
Semua materi normal terdiri dari atom atau komponen-komponen subatom yang membentuk atom; proton, elektron, dan neutron. Atom dapat dikombinasikan untuk menghasilkan bentuk materi yang lebih kompleks seperti ion, molekul, atau kristal. Struktur dunia yang kita jalani sehari-hari dan sifat materi yang berinteraksi dengan kita ditentukan oleh sifat zat-zat kimia dan interaksi antar mereka. Baja lebih keras dari besi karena atom-atomnya terikat dalam struktur kristal yang lebih kaku. Kayu terbakar atau mengalami oksidasi cepat karena ia dapat bereaksi secara spontan dengan oksigen pada suatu reaksi kimia jika berada di atas suatu suhu tertentu.
Zat cenderung diklasifikasikan berdasarkan energi, fase, atau komposisi kimianya. Materi dapat digolongkan dalam 4 fase, urutan dari yang memiliki energi paling rendah adalah padat, cair, gas, dan plasma. Dari keempat jenis fase ini, fase plasma hanya dapat ditemui di luar angkasa yang berupa bintang, karena kebutuhan energinya yang teramat besar. Zat padat memiliki struktur tetap pada suhu kamar yang dapat melawan gravitasi atau gaya lemah lain yang mencoba mengubahnya. Zat cair memiliki ikatan yang terbatas, tanpa struktur, dan akan mengalir bersama gravitasi. Gas tidak memiliki ikatan dan bertindak sebagai partikel bebas. Sementara itu, plasma hanya terdiri dari ion-ion yang bergerak bebas; pasokan energi yang berlebih mencegah ion-ion ini bersatu menjadi partikel unsur. Satu cara untuk membedakan ketiga fase pertama adalah dengan volume dan bentuknya: kasarnya, zat padat memeliki volume dan bentuk yang tetap, zat cair memiliki volume tetap tetapi tanpa bentuk yang tetap, sedangkan gas tidak memiliki baik volume ataupun bentuk yang tetap.

Air (H2O) berbentuk cairan dalam suhu kamar karena molekul-molekulnya terikat oleh gaya antarmolekul yang disebut ikatan hidrogen. Di sisi lain, hidrogen sulfida (H2S) berbentuk gas pada suhu kamar dan tekanan standar, karena molekul-molekulnya terikat dengan interaksi dwikutub (dipol) yang lebih lemah. Ikatan hidrogen pada air memiliki cukup energi untuk mempertahankan molekul air untuk tidak terpisah satu sama lain, tetapi tidak untuk mengalir, yang menjadikannya berwujud cairan dalam suhu antara 0 °C sampai 100 °C pada permukaan laut. Menurunkan suhu atau energi lebih lanjut mengizinkan organisasi bentuk yang lebih erat, menghasilkan suatu zat padat, dan melepaskan energi. Peningkatan energi akan mencairkan es walaupun suhu tidak akan berubah sampai semua es cair. Peningkatan suhu air pada gilirannya akan menyebabkannya mendidih (lihat panas penguapan) sewaktu terdapat cukup energi untuk mengatasi gaya tarik antarmolekul dan selanjutnya memungkinkan molekul untuk bergerak menjauhi satu sama lain.
Ilmuwan yang mempelajari kimia sering disebut kimiawan. Sebagian besar kimiawan melakukan spesialisasi dalam satu atau lebih subdisiplin. Kimia yang diajarkan pada sekolah menengah sering disebut “kimia umum” dan ditujukan sebagai pengantar terhadap banyak konsep-konsep dasar dan untuk memberikan pelajar alat untuk melanjutkan ke subjek lanjutannya. Banyak konsep yang dipresentasikan pada tingkat ini sering dianggap tak lengkap dan tidak akurat secara teknis. Walaupun demikian, hal tersebut merupakan alat yang luar biasa. Kimiawan secara reguler menggunakan alat dan penjelasan yang sederhana dan elegan ini dalam karya mereka, karena terbukti mampu secara akurat membuat model reaktivitas kimia yang sangat bervariasi.
Ilmu kimia secara sejarah merupakan pengembangan baru, tetapi ilmu ini berakar pada alkimia yang telah dipraktikkan selama berabad-abad di seluruh dunia.
Sejarah[sunting | sunting sumber]
Artikel utama: Sejarah kimia
Akar ilmu kimia dapat dilacak hingga fenomena pembakaran. Api merupakan kekuatan mistik yang mengubah suatu zat menjadi zat lain dan karenanya merupakan perhatian utama umat manusia. Adalah api yang menuntun manusia pada penemuan besi dan gelas. Setelah emas ditemukan dan menjadi logam berharga, banyak orang yang tertarik menemukan metode yang dapat mengubah zat lain menjadi emas. Hal ini menciptakan suatu protosains yang disebut Alkimia. Alkimia dipraktikkan oleh banyak kebudayaan sepanjang sejarah dan sering mengandung campuran filsafat, mistisisme, dan protosains.
Alkimiawan menemukan banyak proses kimia yang menuntun pada pengembangan kimia modern. Seiring berjalannya sejarah, alkimiawan-alkimiawan terkemuka (terutama Abu Musa Jabir bin Hayyan dan Paracelsus) mengembangkan alkimia menjauh dari filsafat dan mistisisme dan mengembangkan pendekatan yang lebih sistematik dan ilmiah.[12][13][14][15]
Alkimiawan pertama yang dianggap menerapkan metode ilmiah terhadap alkimia dan membedakan kimia dan alkimia adalah Robert Boyle (1627–1691). Boyle khususnya dianggap sebagai bapak pendiri kimia karena karyanya yang paling penting, teks kimia klasik The Skeptical Chymist yang membuat perbedaan antara klaim alkimia dan penemuan ilmiah empiris dari kimia baru.[16] Ia merumuskan hukum Boyle, menolak “empat unsur” klasik dan mengusulkan alternatif atom dan reaksi kimia mekanistik yang dapat dikenakan percobaan yang keras.[17]

Teori flogiston (suatu zat yang menjadi akar dari semua pembakaran) dikemukakan oleh Georg Ernst Stahl dari Jerman pada awal abad ke-18 dan kemudian dibatalkan pada akhir abad oleh ahli kimia Perancis Antoine Lavoisier, layaknya Newton dalam fisika; yang membuat pijakan bagi kimia modern, dengan menjelaskan prinsip kekekalan massa dan mengembangkan sistem baru penamaan kimia yang digunakan hingga hari ini.[19]
Namun, sebelum karyanya tersebut, banyak penemuan penting telah dibuat, khususnya yang berkaitan dengan sifat ‘udara’ yang ditemukan terdiri dari banyak gas yang berbeda. Kimiawan Skotlandia Joseph Black (ahli kimia eksperimental pertama) dan J.B. van Helmont dari Belanda menemukan karbon dioksida, atau apa yang disebut Black sebagai ‘udara tetap’ pada tahun 1754; Henry Cavendish menemukan hidrogen dan menjelaskan sifat-sifatnya serta Joseph Priestley dan, secara independen, Carl Wilhelm Scheele yang mengisolasi oksigen murni.
Penemuan unsur kimia memiliki sejarah yang panjang yang mencapai puncaknya dengan diciptakannya tabel periodik unsur kimia oleh Dmitri Mendeleyev pada tahun 1869.[20] Ilmuwan Inggris John Dalton mengusulkan teori atom modern; bahwa semua zat tersusun dari ‘atom-atom’ materi dan bahwa atom-atom yang berbeda memiliki berat atom yang berbeda-beda pula.
Perkembangan teori elektrokimia terjadi pada awal abad ke-19 sebagai hasil karya dua ilmuwan khususnya, J.J. Berzelius dan Humphry Davy, dimungkinkan oleh penemuan tumpukan volta sebelumnya oleh Alessandro Volta. Davy menemukan sembilan unsur baru termasuk logam alkali dengan mengekstraksinya dari oksida mereka menggunakan arus listrik.[21]
Penghargaan Nobel dalam Kimia yang diciptakan pada tahun 1901 memberikan gambaran bagus mengenai penemuan kimia selama 100 tahun terakhir. Pada bagian awal abad ke-20, sifat subatomik atom diungkapkan dan ilmu mekanika kuantum mulai menjelaskan sifat fisik ikatan kimia. Pada pertengahan abad ke-20, kimia telah berkembang sampai dapat memahami dan memprediksi aspek-aspek biologi yang melebar ke bidang biokimia.
Industri kimia mewakili suatu aktivitas ekonomi yang penting. Pada tahun 2004, produsen bahan kimia 50 teratas global memiliki penjualan mencapai US$587 miliar dengan margin keuntungan 8,1% dan pengeluaran riset dan pengembangan 2,1% dari total penjualan.[22]
Tahun 2011 dinyatakan oleh Perserikatan Bangsa-Bangsa sebagai Tahun Kimia Internasional.[23] Deklarasi tersebut adalah inisiatif dari IUPAC, dan UNESCO serta melibatkan perkumpulan cendekiawan kimia, akademisi, dan lembaga di seluruh dunia serta mengandalkan inisiatif individu untuk mengorganisasi kegiatan lokal dan regional.
Kimia organik dikembangkan oleh Justus von Liebig dan yang lainnya, menyusul sintesis urea ole Friedrich Wöhler yang membuktikan bahwa organisme hidup, secara teori, dapat berasal dari senyawa kimia.[24] Kemajuan penting lainnya di abad ke-19 adalah; pemahaman tentang ikatan valensi (Edward Frankland pada tahun 1852) dan penerapan termodinamika pada kimia (J. W. Gibbs dan Svante Arrhenius pada tahun 1870-an).
Cabang ilmu kimia[sunting | sunting sumber]
Kimia umumnya dibagi menjadi beberapa bidang utama. Terdapat pula beberapa cabang antar-bidang dan cabang-cabang yang lebih khusus dalam kimia.[25] Lima cabang utama dalam ilmu kimia diantaranya:[26]
- Kimia analitik adalah studi yang melibatkan bagaimana kita menganalisis komponen kimia dalam sampel. Berapa banyak sebenarnya kafeina dalam secangkir kopi? Adakah obat-obatan yang ditemukan dalam sampel urin atlet? Bagaimana tingkat pH kolam renang saya? Contoh bidang yang menggunakan kimia analitik meliputi ilmu forensik, ilmu lingkungan, dan pengujian obat. Kimia analitik dibagi menjadi dua sub cabang: analisis kualitatif dan kuantitatif. Analisis kualitatif menggunakan metode / pemastian untuk membantu menentukan komponen zat (menjawab pertanyaan: apa?). Analisis kuantitatif di sisi lain, membantu untuk mengidentifikasi berapa banyak setiap komponen hadir dalam suatu zat (menjawab pertanyaan: berapa?).
- Biokimia mempelajari senyawa kimia, reaksi kimia, dan interaksi kimia yang terjadi dalam organisme hidup. Biokimia dan kimia organik berhubungan sangat erat, seperti dalam kimia medisinal atau neurokimia. Biokimia juga berhubungan dengan biologi molekular, fisiologi, dan genetika. Di bawah payung utama biokimia banyak sub-cabang baru telah muncul dan banyak ahli kimia modern yang mungkin mengkhususkan diri di dalamnya. Beberapa disiplin ilmu ini meliputi:
- Enzimologi (studi tentang enzim)
- Endokrinologi (studi tentang hormon)
- Biokimia klinik (studi tentang penyakit)
- Biokimia molekuler (studi biomolekul dan fungsinya)
- Kimia anorganik mengkaji sifat-sifat dan reaksi senyawa anorganik. Perbedaan antara bidang organik dan anorganik tidaklah mutlak dan banyak terdapat tumpang tindih, khususnya dalam bidang kimia organologam. Kimiawan di bidang ini fokus pada unsur-unsur dan senyawa lain selain karbon atau hidrokarbon. Sederhananya, kimia anorganik meliputi semua bahan yang tidak organik dan disebut sebagai zat tak-hidup – senyawa yang tidak mengandung ikatan karbon-hidrogen (CH). Senyawa yang dipelajari oleh ahli kimia anorganik meliputi struktur kristal, mineral, logam, katalis, dan sebagian besar unsur pada tabel periodik. Contohnya adalah kekuatan balok daya yang digunakan untuk membawa berat tertentu atau menyelidiki bagaimana emas terbentuk di bumi. Cabang kimia anorganik meliputi:
- Kimia bioanorganik (studi peran logam dalam biologi)
- Kimia koordinasi (studi senyawa koordinasi dan interaksi ligan)
- Geokimia (studi komposisi kimia bumi, batuan, mineral & atmosfer)
- Teknologi anorganik (sintesis senyawa anorganik baru)
- Kimia nuklir (studi bahan radioaktif)
- Kimia organologam (studi bahan kimia yang mengandung ikatan antara logam dan karbon–tumpangsuh dengan kimia organik)
- Kimia padatan / kimia material (studi pembentukan, struktur, dan karakteristik material fasa padat)
- Kimia anorganik sintesis (studi sintesis bahan kimia)
- Kimia anorganik industrial (studi material yang digunakan dalam industri. Contoh: pupuk)
- Kimia organik adalah ilmu yang mempelajari senyawa karbon seperti bahan bakar, plastik, aditif makanan, dan obat-obatan. Berlawanan kimia anorganik yang berfokus pada masalah tak-hidup dan zat berbasis non-karbon, kimia organik berurusan dengan studi karbon dan bahan kimia dalam organisme hidup. Contohnya adalah proses fotosintesis di daun karena ada perubahan dalam komposisi kimia dari tanaman hidup. Cabang-cabang dari kimia organik melibatkan banyak disiplin ilmu yang berbeda termasuk studi keton, aldehid, hidrokarbon (alkena, alkana, alkuna) dan alkohol.
- Stereokimia (studi struktur molekul 3-dimensi)
- Kimia medisinal (berurusan dengan perancangan, pengembangan dan sintesis obat-obatan farmasi)
- Kimia organologam (studi bahan kimia yang mengandung ikatan antra karbon dan logam)
- Kimia organik fisik (studi struktur dan reaktivitas dalam molekul organik)
- Kimia polimer (studi komposisi dan pembentukan molekul polimer)
- Kimia fisik adalah studi tentang sifat fisik molekul, dan hubungannya dengan cara menyatukan molekul dan atom. Kimia fisik berurusan dengan prinsip-prinsip dan metodologi baik kimia dan fisika serta merupakan studi tentang bagaimana struktur kimia berpengaruh terhadap sifat fisik suatu zat. Contohnya adalah pembuatan brownies, karena ada pencampuran bahan serta menggunakan panas dan energi untuk mendapatkan produk akhir. Sub-cabang kimia fisik meliputi:
- Elektrokimia (studi interaksi atom, molekul, ion dan arus listrik)
- Fotokimia (studi efek kimia cahaya; reaksi fotokimia)
- Kimia permukaan (studi reaksi kimia pada permukaan)
- Kinetika kimia (studi laju reaksi kimia)
- Termodinamika/termokimia (studi hubungan panas dengan perubahan kimia)
- Mekanika kuantum/kimia kuantum (studi mekanika kuantum dan hubungannya dengan fenomena kimia)
- Spektroskopi (studi spektrum cahaya atau radiasi)
Cabang-cabang ilmu kimia yang merupakan tumpang-tindih dengan satu atau lebih lima cabang utama:
- Kimia material menyangkut bagaimana menyiapkan, mengkarakterisasi, dan memahami cara kerja suatu bahan dengan kegunaan praktis.
- Kimia teori adalah studi kimia melalui penjabaran teori dasar (biasanya dalam matematika atau fisika). Secara spesifik, penerapan mekanika kuantum dalam kimia disebut kimia kuantum. Sejak akhir Perang Dunia II, perkembangan komputer telah memfasilitasi pengembangan sistematik kimia komputasi, yang merupakan seni pengembangan dan penerapan program komputer untuk menyelesaikan permasalahan kimia. Kimia teori memiliki banyak tumpang tindih (secara teori dan eksperimen) dengan fisika benda kondensi dan fisika molekular.
- Kimia nuklir mengkaji bagaimana partikel subatom bergabung dan membentuk inti. Transmutasi modern adalah bagian terbesar dari kimia nuklir dan tabel nuklida merupakan hasil sekaligus perangkat untuk bidang ini.
- Kimia organik bahan alam mempelajari senyawa organik yang disintesis secara alami oleh alam, khususnya makhluk hidup.
Bidang lain antara lain adalah astrokimia, biologi molekular, elektrokimia, farmakologi, fitokimia, fotokimia, genetika molekular, geokimia, ilmu bahan, kimia aliran, kimia atmosfer, kimia benda padat, kimia hijau, kimia inti, kimia medisinal, kimia komputasi, kimia lingkungan, kimia organologam, kimia permukaan, kimia polimer, kimia supramolekular, nanoteknologi, petrokimia, sejarah kimia, sonokimia, teknik kimia, serta termokimia.
Konsep dasar[sunting | sunting sumber]
Tatanama[sunting | sunting sumber]
Artikel utama: Tatanama IUPAC

Tatanama kimia merujuk pada sistem penamaan senyawa kimia. Telah dibuat sistem penamaan spesies kimia yang terdefinisi dengan baik. Senyawa organik diberi nama menurut sistem tatanama organik. Senyawa anorganik dinamai menurut sistem tatanama anorganik.
Atom[sunting | sunting sumber]
Artikel utama: Atom
Atom adalah suatu kumpulan materi yang terdiri atas inti yang bermuatan positif, yang biasanya mengandung proton dan neutron, dan beberapa elektron di sekitarnya yang mengimbangi muatan positif inti. Atom juga merupakan satuan terkecil yang dapat diuraikan dari suatu unsur dan masih mempertahankan sifatnya, terbentuk dari inti yang rapat dan bermuatan positif dikelilingi oleh suatu sistem elektron. Dalam atom netral, elektron yang bermuatan negatif mengimbangi muatan positif pada proton. Inti atom sangat padat; massa nukleon adalah 1,836 kali dari elektron, namun jari-jari atom adalah sekitar 10,000 kali dari intinya.[27][28]
atom juga merupakan entitas terkecil yang dapat dipertimbangkan untuk mempertahankan sifat kimia dari unsur, seperti elektronegativitas, energi ionisasi, keadaan oksidasi, dan jenis ikatan yang lebih disukai untuk dibentuk (misalnya, logam, ionik, kovalen).
Unsur[sunting | sunting sumber]
Artikel utama: Unsur kimia

Unsur adalah sekelompok atom yang memiliki jumlah proton yang sama pada intinya. Jumlah ini disebut sebagai nomor atom unsur. Sebagai contoh, semua atom yang memiliki 6 proton pada intinya adalah atom dari unsur kimia karbon, dan semua atom yang memiliki 92 proton pada intinya adalah atom unsur uranium.[28]
Presentasi standar dari unsur-unsur kimia berada dalam tabel periodik, yang mengurutkan unsur berdasarkan nomor atom. Tabel periodik diatur dalam golongan, atau kolom, dan periode, atau baris. Tabel periodik berguna dalam mengidentifikasi tren periodik.[29]
Senyawa[sunting | sunting sumber]
Artikel utama: Senyawa kimia

Senyawa merupakan suatu zat yang dibentuk oleh dua atau lebih unsur dengan perbandingan tetap yang menentukan susunannya. sebagai contoh, air merupakan senyawa yang mengandung hidrogen dan oksigen dengan perbandingan dua terhadap satu. Senyawa dibentuk dan diuraikan oleh reaksi kimia.[30]
Penamaan standar senyawa diatur oleh International Union of Pure and Applied Chemistry (IUPAC). Senyawa organik diberi nama berdasarkan sistem tata nama organik.[31] Senyawa anorganik diberi nama berdasarkan sistem tata nama anorganik.[32] Sebagai tambahan, Chemical Abstracts Service telah menemukan metode untuk mengindeks zat kimia. Dalam skema ini setiap bahan kimia diidentifikasi oleh nomor yang dikenal sebagai Nomor Registrasi CAS.
Molekul[sunting | sunting sumber]
Artikel utama: Molekul
Molekul adalah bagian terkecil dan tidak terpecah dari suatu senyawa kimia murni yang masih mempertahankan sifat kimia dan fisik yang unik. Suatu molekul terdiri dari dua atau lebih atom yang terikat satu sama lain.[33][34] Molekul biasanya adalah seperangkat atom yang terikat bersama oleh ikatan kovalen, sehingga strukturnya netral secara kelistrikan dan semua elektron valensi berpasangan dengan elektron lain baik dalam ikatan atau dalam pasangan elektron bebas.[35]
Dengan demikian, molekul hadir sebagai satuan netral secara kelistrikan, tidak seperti ion. Ketika aturan ini dilanggar, memberikan muatan bagi “molekul”, hasilnya terkadang dinamai sebagai ion molekuler atau ion poliatomik. Namun, sifat diskrit dan terpisah dari konsep molekul biasanya mensyaratkan bahwa ion molekuler hanya hadir dalam bentuk yang dipisahkan dengan baik, seperti sinar diarahkan dalam ruang hampa udara dalam spektrometer massa. Kumpulan poliatom bermuatan yang berada dalam padatan (misalnya, ion sulfat atau nitrat sejenis) umumnya tidak dianggap “molekul” dalam kimia. Beberapa molekul mengandung satu atau lebih elektron yang tidak berpasangan, menciptakan radikal. Kebanyakan radikal relatif reaktif, tetapi beberapa diantaranya, seperti nitrogen monoksida (NO) dapat bersifat stabil.
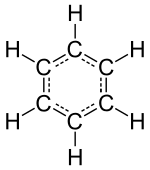
Unsur gas “inert” atau gas mulia (helium, neon, argon, kripton, xenon dan radon) terdiri dari atom tunggal sebagai satu unit diskrit terkecilnya, namun unsur-unsur kimia yang terisolasi lain terdiri dari baik molekul atau jaringan atom terikat satu sama lain dalam beberapa cara. Molekul yang mudah diidentifikasi menyusun berbagai zat yang dikenal seperti air, udara, dan banyak senyawa organik seperti alkohol, gula, bensin, dan berbagai obat-obatan.
Namun, tidak semua zat atau senyawa kimia terdiri dari molekul diskrit, dan memang sebagian besar zat padat yang membentuk kerak, mantel, dan inti bumi adalah senyawa kimia tanpa molekul. Jenis lain dari zat tersebut, seperti senyawa ionik dan jaringan padatan, yang diatur sedemikian rupa karena kurangnya keberadaan molekul yang dapat diidentifikasi per se. Contoh zat dengan jenis ini seperti garam mineral (seperti garam dapur), padatan seperti karbon dan berlian, logam, dan silika serta mineral silikat seperti kuarsa dan granit.
Salah satu karakteristik utama dari molekul adalah geometrinya yang dikenal sebagai struktur. Sementara struktur molekul atom diatomik, triatomik atau tetra atomik mungkin tidak terlalu signifikan, (linear, piramida sudut, dan sebagainya) struktur molekul poliatomik, yang merupakan lebih dari enam atom (dari beberapa unsur) dapat menjadi sangat penting bagi kimia di alam.
Zat kimia[sunting | sunting sumber]
Artikel utama: Zat kimia
| Contoh zat kimia murni. Dari kiri ke kanan: unsur timah (Sn) dan belerang (S), intan (suatu alotrop dari karbon), sukrosa (gula murni), dan natrium klorida (garam) serta natrium bikarbonat (soda kue), yang keduanya merupakan senyawa ionik. |
Suatu ‘zat kimia’ dapat berupa suatu unsur, senyawa, atau campuran senyawa-senyawa, unsur-unsur, atau senyawa dan unsur. Sebagian besar materi yang kita temukan dalam kehidupan sehari-hari merupakan suatu bentuk campuran, misalnya air, aloy, biomassa, dll.
Zat kimia adalah jenis materi dengan komposisi dan sifat yang pasti.[36] Kumpulan zat disebut dengan campuran. Beberapa contoh campuran adalah udara dan aloy.[37]
Mol dan jumlah zat[sunting | sunting sumber]
Artikel utama: Mol
Mol adalah satuan pengukuran yang menunjukkan jumlah zat (juga disebut sebagai jumlah bahan kimia). Mol didefinisikan sebagai jumlah atom yang ditemukan persis 0.012 kilogram (atau 12 grams) pada karbon-12, di mana atom karbon-12 tidak terikat, diam dan berada pada keadaan dasarnya.[38] Jumlah entitas per mol dikenal sebagai bilangan Avogadro, serta ditentukan secara empiris mencapai sekitar 6.022×1023 mol−1.[39] Konsentrasi molar adalah jumlah zat tertentu per volume larutan, dan umumnya dilaporkan dalam mol dm−3.[40]
Wujud zat[sunting | sunting sumber]
Artikel utama: Fase zat

Fase adalah kumpulan keadaan sebuah sistem fisik makroskopis yang relatif serbasama baik itu komposisi kimianya maupun sifat-sifat fisikanya (misalnya masa jenis, struktur kristal, indeks refraksi, dan lain sebagainya). Contoh keadaan fase yang kita kenal adalah padatan, cair, dan gas. Keadaan fase yang lain yang misalnya plasma, kondensasi Bose-Einstein, dan kondensasi Fermion. Keadaan fase dari material magnetik adalah paramagnetik, feromagnetik dan diamagnetik.
Sifat-sifat fisik, seperti kerapatan dan indeks bias cenderung masuk dalam karakteristik nilai fase. Fase materi didefinisikan oleh transisi fase, yaitu ketika energi yang dimasukkan atau dikeluarkan dari sistem digunakan untuk menata ulang struktur sistem, alih-alih mengubah kondisi ruahnya.
Terkadang perbedaan antara fase dapat dapat berlangsung terus menerus daripada memiliki batas yang diskrit, dalam hal ini materi dianggap dalam keadaan superkritis. Ketika tiga keadaan bertemu berdasarkan kondisi tertentu, keadaan tersebut dikenal sebagai titik tripel dan karena ini merupakan invarian, hal ini merupakan cara yang mudah untuk menentukan satu set kondisi.
Contoh fase yang banyak dikenal antara lain padat, cair dan gas. Banyak zat menunjukkan beberapa fase padat. Sebagai contoh, terdapat tiga fase padatan besi (alfa, gamma, dan delta) yang bervariasi berdasarkan suhu dan tekanannya. Perbedaan utama antara fase-fase padat tersebut adalah struktur kristal, atau susunan, dari atom-atomnya. Fase lain yang umum ditemui dalam studi kimia adalah fase ‘berair’, yang merupakan keadaan zat yang dilarutkan dalam larutan berair (yaitu, dalam air).
Fase yang kurang banyak dikenal antara lain plasma, kondensat Bose–Einstein dan kondensat fermionik serta fase paramagnetik dan feromagnetik pada material magnetik. Sementara fase-fase yang banyak dikenal berurusan dengan sistem tiga dimensi, juga dimungkinkan untuk mendefinisikan analognya dalam sistem dua dimensi, yang menarik perhatian karena relevansinya dengan sistem dalam biologi.
Ikatan kimia[sunting | sunting sumber]
Artikel utama: Ikatan kimia
Ikatan kimia merupakan gaya yang menahan berkumpulnya atom-atom dalam molekul atau kristal. Pada banyak senyawa sederhana, teori ikatan valensi dan konsep bilangan oksidasi dapat digunakan untuk menduga struktur molekular dan susunannya. Serupa dengan ini, teori-teori dari fisika klasik dapat digunakan untuk menduga banyak dari struktur ionik. Pada senyawa yang lebih kompleks/rumit, seperti kompleks logam, teori ikatan valensi tidak dapat digunakan karena membutuhken pemahaman yang lebih dalam dengan basis mekanika kuantum.
Sebuah ikatan kimia dapat berupa ikatan kovalen, ikatan ionik, ikatan hidrogen atau hanya karena gaya Van der Waals. Masing-masing jenis ikatan dianggap berasal sejumlah potensial. Potensial ini menciptakan interaksi yang memegang atom bersama-sama dalam molekul atau kristal. Dalam banyak senyawa sederhana, teori ikatan valensi, model Valence Shell Electron Pair Repulsion (teori VSEPR), dan konsep bilangan oksidasi dapat digunakan untuk menjelaskan struktur dan komposisi molekul.
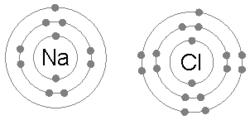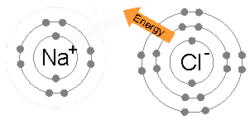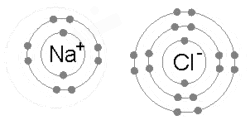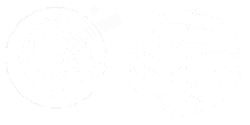
Ikatan ionik terbentuk ketika logam kehilangan satu atau lebih elektron, menjadi kation bermuatan positif, serta elektron kemudian ditarik oleh atom non-logam, menjadi anion bermuatan negatif. Kedua ion bermuatan berlawanan menarik satu sama lain, dan ikatan ion adalah gaya elektrostatik tarik di antara keduanya. Misalnya, natrium (Na), logam, kehilangan satu elektron untuk menjadi kation Na+ sementara klor (Cl), non-logam, menerima elektron ini untuk menjadi Cl–. Ion-ion akan diikat menjadi satu karena daya tarik elektrostatik, serta senyawa natrium klorida (NaCl), atau garam dapur biasa, terbentuk.
Dalam ikatan kovalen, satu atau lebih pasangan elektron valensi dibagi oleh dua atom: gugus atom terikat netral yang dihasilkan disebut sebagai molekul. Atom akan berbagi elektron valensi sedemikian rupa untuk menciptakan konfigurasi elektron gas mulia (delapan elektron di kulit terluarnya) untuk masing-masing atom. Atom yang cenderung bergabung sedemikian rupa sehingga masing-masing memiliki delapan elektron dalam kulit valensinya dikatakan mengikuti aturan oktet. Namun, beberapa unsur seperti hidrogen dan litium hanya membutuhkan dua elektron di kulit terluarnya untuk mendapatkan konfigurasi stabil ini; atom-atom ini dikatakan mengikuti “aturan duet”, dan dengan cara ini mereka mencapai konfigurasi elektron dari gas mulia helium, yang memiliki dua elektron di kulit terluarnya.
Serupa dengan itu, teori-teori dari fisika klasik dapat digunakan untuk memprediksi banyak struktur ionik. Dengan senyawa yang lebih rumit, seperti kompleks logam, teori ikatan valensi kurang berlaku dan pendekatan alternatif, seperti teori orbital molekul, umumnya digunakan.
Energi[sunting | sunting sumber]
Artikel utama: Energi
Dalam konteks kimia, energi adalah atribut suatu zat sebagai konsekuensi dari struktur atomik, molekul atau agregat. Karena perubahan kimia disertai dengan perubahan dalam satu atau lebih dari jenis struktur ini, selalu disertai dengan peningkatan atau penurunan energi dari zat yang terlibat. Sebagian energi dipindahkan antara lingkungan dan reaktan reaksi dalam bentuk panas atau cahaya; dengan demikian produk dari suatu reaksi dapat memiliki energi lebih atau kurang dari reaktan.
Suatu reaksi dikatakan eksergonik jika energi pada keadaan akhir lebih rendah daripada keadaan awal; dalam kasus reaksi endergonik situasinya terbalik. Suatu reaksi dikatakan eksotermik jika reaksi melepaskan panas ke lingkungan; dalam kasus reaksi endotermik, reaksi menyerap panas dari lingkungan.
Reaksi kimia selalu tidak mungkin terjadi kecuali reaktan melampaui penghalang energi yang dikenal sebagai energi aktivasi. Kecepatan dari reaksi kimia (pada suhu yang diberikan T) terkait dengan energi aktivasi E, oleh faktor populasi Boltzmann 𝑒−𝐸/𝑘𝑇
Transfer energi dari satu zat kimia ke zat lain bergantung pada ukuran kuanta energi yang diemisikan oleh satu zat. Namun, energi panas sering kali lebih mudah ditransfer dari hampir semua zat ke zat lain karena fonon yang bertanggung jawab terhadap tingkat energi vibrasi dan rotasi dalam suatu zat, memiliki energi yang jauh lebih sedikit daripada foton yang digunakan untuk transfer energi elektronik. Dengan demikian, karena tingkat energi vibrasi dan rotasi lebih dekat dari tingkat energi elektronik, panas lebih mudah ditransfer antara zat relatif terhadap cahaya atau bentuk lain dari energi elektronik. Sebagai contoh, radiasi elektromagnetik ultraviolet tidak ditransfer lebih baik dari satu zat ke zat yang lain daripada energi termal atau listrik.
Keberadaan tingkat energi yang khas untuk zat kimia yang berbeda berguna untuk identifikasi mereka dengan analisis garis spektrum. Berbagai jenis spektrum sering digunakan dalam spektroskopi kimia, misalnya IR, gelombang mikro, NMR, ESR, dan lain sebagainya. Spektroskopi juga digunakan untuk mengidentifikasi komposisi objek jarak jauh–seperti bintang dan galaksi yang jauh–dengan menganalisis spektrum radiasi mereka.

istilah energi kimia terkadang digunakan untuk menunjukkan potensi suatu zat kimia untuk mengalami transformasi melalui reaksi kimia atau mengubah zat kimia lainnya.
Reaksi kimia[sunting | sunting sumber]
Artikel utama: Reaksi kimia

Reaksi kimia adalah transformasi/perubahan dalam struktur molekul. Reaksi ini bisa menghasilkan penggabungan molekul membentuk molekul yang lebih besar, pembelahan molekul menjadi dua atau lebih molekul yang lebih kecil, atau penataulangan atom-atom dalam molekul. Reaksi kimia selalu melibatkan terbentuk atau terputusnya ikatan kimia. Oksidasi, reduksi, disosiasi, netralisasi asam-basa serta reaksi penataan ulang molekul adalah beberapa jenis reaksi kimia yang umum digunakan.
Reaksi kimia dapat secara simbolis digambarkan melalui persamaan kimia. Sementara dalam reaksi kimia non-inti jumlah serta jenis atom pada kedua sisi persamaan adalah sama, untuk reaksi inti ini berlaku hanya untuk partikel inti yaitu proton dan neutron.[42]
Urutan tahapan yang mengatur-ulang ikatan kimia dapat terjadi dalam perjalanan reaksi kimia yang disebut sebagai mekanismenya. Reaksi kimia dapat dibayangkan terjadi dalam sejumlah tahap, yang masing-masing dapat memiliki kecepatan yang berbeda. Banyak reaksi intermediet memiliki stabilitas yang bervariasi sehingga dapat digambarkan selama reaksi. Mekanisme reaksi diajukan untuk menjelaskan kinetika serta campuran produk relatif dari suatu reaksi.
Menurut buku emas IUPAC, reaksi kimia adalah “proses yang menghasilkan interkonversi spesi kimia.”[43] Karenanya, reaksi kimia dapat berupa reaksi elementer atau reaksi bertahap. Peringatan tambahan dibuat, dalam definisi ini termasuk kasus-kasus di mana interkonversi konformer dapat diamati secara eksperimental. Reaksi kimia yang terdeteksi tersebut biasanya melibatkan kumpulan entitas molekuler seperti yang ditunjukkan oleh definisi ini, tetapi sering secara konsep untuk menggunakan istilah ini pula dengan mudah bagi perubahan yang melibatkan entitas molekul tunggal.
Ion dan garam[sunting | sunting sumber]
Artikel utama: Ion

Suatu ion adalah spesi bermuatan, suatu atom atau molekul, yang telah kehilangan atau memperoleh satu atau lebih elektron. Ketika sebuah atom kehilangan satu elektron dan karenanya memiliki lebih banyak proton daripada elektron, atom tersebut adalah ion bermuatan positif atau kation.[44] Ketika atom memperoleh elektron dan karenanya memiliki lebih banyak elektron daripada proton, atom adalah ion bermuatan negatif atau anion.[45] Kation dan anion dapat membentuk kisi kristal garam netral, seperti ion Na+ dan Cl– yang membentuk natrium klorida, atau NaCl. Contoh ion poliatomik yang tidak terpecah selama reaksi asam-basa adalah hidroksida (OH−) dan fosfat (PO43−).
Plasma terdiri dari materi gas yang telah sepenuhnya terionisasi, biasanya melalui suhu tinggi.
Keasaman dan kebasaan[sunting | sunting sumber]
Artikel utama: Reaksi asam-basa
Suatu zat sering dapat diklasifikasikan sebagai asam atau basa. Ada beberapa teori berbeda yang menjelaskan perilaku asam-basa.[46] Teori yang paling sederhana adalah teori Arrhenius, yang menyatakan bahwa asam adalah zat yang menghasilkan ion hidronium ketika dilarutkan dalam air, dan basa adalah yang menghasilkan ion hidroksida bila dilarutkan dalam air. Menurut teori Brønsted–Lowry, asam adalah zat yang menyumbangkan ion hidrogen positif kepada zat lain dalam reaksi kimia; dengan pernyataan tersebut, karenanya, basa adalah zat yang menerima ion hidrogen tersebut.[47][48]
Teori asam-basa ketiga adalah teori Lewis, yang didasarkan pada pembentukan ikatan kimia baru.[49] Teori Lewis menjelaskan bahwa asam adalah zat yang mampu menerima sepasang elektron dari zat lain selama proses pembentukan ikatan, sedangkan basa adalah zat yang dapat menyediakan sepasang elektron untuk membentuk ikatan baru.[50] Menurut teori ini, hal-hal penting yang dipertukarkan adalah muatannya. Ada beberapa cara lain di mana suatu zat dapat diklasifikasikan sebagai asam atau basa, seperti terbukti dalam sejarah konsep ini.[51]
Kekuatan asam biasanya diukur dengan dua metode. Salah satu pengukuran, berdasarkan definisi keasaman Arrhenius, adalah pH, yang merupakan pengukuran konsentrasi ion hidronium dalam larutan, sebagaimana dinyatakan pada skala negatif logaritma. Dengan demikian, larutan yang memiliki pH rendah memiliki konsentrasi ion hidronium yang tinggi dan dapat dikatakan lebih asam. Pengukuran lainnya, berdasarkan pada definisi Brønsted–Lowry, adalah konstanta disosiasi asam (Ka), yang mengukur kemampuan relatif suatu zat untuk bertindak sebagai asam di bawah definisi asam Brønsted-Lowry. Artinya, zat dengan Ka yang lebih tinggi lebih mungkin untuk menyumbangkan ion hidrogen dalam reaksi kimia dibandingkan dengan Ka yang lebih rendah.
Redoks[sunting | sunting sumber]
Artikel utama: Redoks
Reaksi redoks (reduksi-oksidasi) terdiri dari seluruh reaksi kimia yang membuat atom mengalami perubahan bilangan oksidasi mereka baik dengan mendapatkan elektron (reduksi) atau kehilangan elektron (oksidasi). Zat yang memiliki kemampuan untuk mengoksidasi zat lain dikatakan oksidatif dan dikenal sebagai agen pengoksidasi, oksidator atau pengoksidasi. Oksidator menghilangkan elektron dari zat lain. Demikian pula, zat yang memiliki kemampuan untuk mengurangi zat lain dikatakan reduktif dan dikenal sebagai agen pereduksi, reduktor, atau pereduksi.[52]
Reduktor mentransfer elektron ke zat lain dan karenanya zat reduktor teroksidasi sendiri. Dan, karena ia “menyumbangkan” elektron, ia juga disebut donor elektron. Oksidasi dan reduksi secara tepat mengacu pada perubahan bilangan oksidasi—transfer elektron yang sebenarnya mungkin tidak pernah terjadi. Jadi, oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi.
Kesetimbangan[sunting | sunting sumber]
Artikel utama: Kesetimbangan kimia
Meskipun konsep kesetimbangan banyak digunakan di berbagai bidang ilmu pengetahuan, dalam konteks ilmu kimia, konsep ini muncul setiap kali sejumlah keadaan yang berbeda dari komposisi kimia dimungkinkan, seperti misalnya, dalam campuran beberapa senyawa kimia yang dapat bereaksi satu sama lain, atau ketika suatu zat dapat hadir dalam lebih dari satu jenis fase.
Suatu sistem zat-zat kimia pada kesetimbangan, walaupun memiliki komposisi yang tidak berubah, paling sering tidak statis; molekul zat terus bereaksi satu sama lain sehingga memunculkan kesetimbangan dinamis. Dengan demikian konsep tersebut menggambarkan keadaan ketika parameter seperti komposisi kimia tetap tidak berubah dari waktu ke waktu.
Kimia kuantum[sunting | sunting sumber]
Artikel utama: Kimia kuantum
Kimia kuantum secara matematis menjelaskan kelakuan dasar materi pada tingkat molekul. Secara prinsip, dimungkinkan untuk menjelaskan semua sistem kimia dengan menggunakan teori ini. Dalam praktiknya, hanya sistem kimia paling sederhana yang dapat secara realistis diinvestigasi dengan mekanika kuantum murni dan harus dilakukan hampiran untuk sebagian besar tujuan praktis (misalnya, Hartree-Fock, pasca-Hartree-Fock, atau teori fungsi kerapatan, lihat kimia komputasi untuk detailnya). Karenanya, pemahaman mendalam mekanika kuantum tidak diperlukan bagi sebagian besar bidang kimia karena implikasi penting dari teori (terutama hampiran orbital) dapat dipahami dan diterapkan dengan lebih sederhana.
Dalam mekanika kuantum (beberapa penerapan dalam kimia komputasi dan kimia kuantum), Hamiltonan, atau keadaan fisik, dari partikel dapat dinyatakan sebagai penjumlahan dua operator, satu berhubungan dengan energi kinetik dan satunya dengan energi potensial. Hamiltonan dalam persamaan gelombang Schrödinger yang digunakan dalam kimia kuantum tidak memiliki terminologi bagi putaran elektron.
Penyelesaian persamaan Schrödinger untuk atom hidrogen memberikan bentuk persamaan gelombang untuk orbital atom, dan energi relatif dari orbital 1s, 2s, 2p, dan 3p. Hampiran orbital dapat digunakan untuk memahami atom lainnya seperti helium, litium, dan karbon.
Hukum kimia[sunting | sunting sumber]
Artikel utama: Hukum kimia
Hukum-hukum kimia sebenarnya merupakan hukum fisika yang diterapkan dalam sistem kimia. Konsep yang paling mendasar dalam kimia adalah Hukum kekekalan massa yang menyatakan bahwa tidak ada perubahan jumlah zat yang terukur pada saat reaksi kimia biasa. Fisika modern menunjukkan bahwa sebenarnya energilah yang kekal, dan bahwa energi dan massa saling berkaitan. Kekekalan energi ini mengarahkan kepada pentingnya konsep kesetimbangan, termodinamika, dan kinetika.
Reaksi kimia diatur oleh hukum-hukum tertentu, yang telah menjadi konsep dasar dalam kimia. Beberapa hukum tersebut adalah:
- Hukum Avogadro
- Hukum Boyle (1662, menghubungkan tekanan dan volume)
- Hukum Charles (1787, menghubungkan volume dan suhu)
- Hukum Gay-Lussac (1809, menghubungkan tekanan dan suhu)
- Prinsip Le Chatelier
- Hukum Henry
- Hukum Hess
- Hukum kekekalan energi
- Hukum kekekalan massa
- Hukum perbandingan tetap
- Hukum perbandingan berganda
- Hukum Raoult
Industri Kimia[sunting | sunting sumber]
Artikel utama: Industri kimia
Industri kimia adalah salah satu aktivitas ekonomi yang penting. Top 50 produser kimia dunia pada tahun 2004 mempunyai penjualan sebesar USD $587 miliar dengan profit margin sebesar 8.1% dan pengeluaran rekayasa (riset dan pengembangan) sebesar 2.1% dari total penjualan kimia.[22]
Perhimpunan profesional[sunting | sunting sumber]
- American Chemical Society
- American Society for Neurochemistry
- Himpunan Kimia Indonesia
- International Union of Pure and Applied Chemistry
- Royal Society of Chemistry
- Society of Chemical Industry
- World Association of Theoretical and Computational Chemists
Lihat pula[sunting | sunting sumber]
- Daftar senyawa kimia
- Daftar kimiawan
- International Union of Pure and Applied Chemistry
- Tabel periodik
- Teknik kimia
- Himpunan Kimia Indonesia
Referensi[sunting | sunting sumber]
- ^ “What is Chemistry?”. Chemweb.ucc.ie. Diarsipkan dari versi asli tanggal 2018-10-03. Diakses tanggal 2011-06-12.
- ^ Chemistry. (n.d.). Merriam-Webster’s Medical Dictionary. Diakses 19 Agustus 2007.
- ^ Theodore L. Brown, H. Eugene Lemay, Bruce Edward Bursten, H. Lemay. Chemistry: The Central Science. Prentice Hall; edisi 8 (1999). ISBN 0-13-010310-1. Hlm. 3–4.
- ^ Kimia berada pada suatu posisi antara dalam suatu hirarki ilmu-ilmu pengetahuan dengan menjembatani fisika dan biologi. Carsten Reinhardt. Chemical Sciences in the 20th Century: Bridging Boundaries. Wiley-VCH, 2001. ISBN 3-527-30271-9. Hlm. 1–2.
- ^ Bunge, M. (1982). “Is chemistry a branch of physics?”. Journal for the General Philosophy of Science – Zeitschrift für allgemeine Wissenschaftstheorie. 13 (2): 209–223. doi:10.1007/BF01801556.
- ^ “History of Alchemy”. Alchemy Lab. Diakses tanggal 2011-06-12.
- ^ Strathern, P. (2000). Mendeleyev’s Dream–the Quest for the Elements. New York: Berkley Books.
- ^ Lompat ke:a b “alchemy”, entry in The Oxford English Dictionary, J. A. Simpson and E. S. C. Weiner, Jil. 1, Edisi ke-2, 1989, ISBN 0-19-861213-3.
- ^ hal. 854, “Arabic alchemy”, Georges C. Anawati, hal. 853–885 dalam Encyclopedia of the history of Arabic science, editor Roshdi Rashed dan Régis Morelon, London: Routledge, 1996, jil. 3, ISBN 0-415-12412-3.
- ^ Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. ISBN 0-486-21873-2
- ^ “Chemistry – The Central Science”. The Chemistry Hall of Fame. York University. Diakses tanggal 2006-09-12.
- ^ Derewenda, Zygmunt S.; Derewenda, ZS (2007). “On wine, chirality and crystallography”. Acta Crystallographica Section A. 64 (Pt 1): 246–258 [247]. Bibcode:2008AcCrA..64..246D. doi:10.1107/S0108767307054293. PMID 18156689.
- ^ John Warren (2005). “War and the Cultural Heritage of Iraq: a sadly mismanaged affair”, Third World Quarterly, Volume 26, Issue 4 & 5, hlm. 815–830.
- ^ Dr. A. Zahoor (1997), Jâbir ibn Hayyân (Geber) Diarsipkan 2017-09-21 di Wayback Machine.
- ^ Paul Vallely, How Islamic inventors changed the world, The Independent, 10 Maret 2006
- ^ “Robert Boyle, Founder of Modern Chemistry” Harry Sootin (2011)
- ^ “History–Robert Boyle (1627–1691)”. BBC. Diakses tanggal 2011-06-12.
- ^ Eagle, Cassandra T.; Jennifer Sloan (1998). “Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry”. The Chemical Educator. 3 (5): 1–18. doi:10.1007/s00897980249a.
- ^ Mi Gyung Kim (2003). Affinity, that Elusive Dream: A Genealogy of the Chemical Revolution. MIT Press. hlm. 440. ISBN 978-0-262-11273-4.
- ^ Note: “…it is surely true that had Mendeleev never lived modern chemists would be using a Periodic Table” and “Dmitri Mendeleev”. Royal Society of Chemistry. Diakses tanggal 18 Juli 2015.
- ^ Davy, Humphry (1808). “On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases”. Philosophical Transactions of the Royal Society. 98: 1–45. doi:10.1098/rstl.1808.0001.
- ^ Lompat ke:a b “Top 50 Chemical Producers”. Chemical & Engineering News. 83 (29): 20–23. 18 Juli, 2005.
- ^ “Chemistry”. Chemistry2011.org. Diarsipkan dari versi asli tanggal 2011-10-08. Diakses tanggal 2012-03-10.
- ^ Ihde, Aaron John (1984). The Development of Modern Chemistry. Courier Dover Publications. hlm. 164. ISBN 978-0-486-64235-2.
- ^ W.G. Laidlaw; D.E. Ryan And Gary Horlick; H.C. Clark, Josef Takats, And Martin Cowie; R.U. Lemieux (1986-12-10). “Chemistry Subdisciplines”. The Canadian Encyclopedia. Diarsipkan dari versi asli tanggal 2013-09-27. Diakses tanggal 2011-06-12.
- ^ Main Branches of Chemistry
- ^ Burrows et al. 2009, hlm. 13.
- ^ Lompat ke:a b Housecroft & Sharpe 2008, hlm. 2.
- ^ Burrows et al. 2009, hlm. 110.
- ^ Burrows et al. 2009, hlm. 12.
- ^ “IUPAC Nomenclature of Organic Chemistry”. Acdlabs.com. Diakses tanggal 2011-06-12.
- ^ Connelly, Neil G.; Damhus, Ture; Hartshorn, Richard M.; Hutton, Alan T. (2005). Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005. RSCPublishing. hlm. 5–12. ISBN 978-0-85404-438-2.
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 (“Buku Emas”) (1997). Versi koreksi daring: (2006–) “Molecule“.
- ^ Ebbin, Darrell D. (1990). General Chemistry (edisi ke-3). Boston: Houghton Mifflin Co. ISBN 0-395-43302-9.
- ^ Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Chemistry–the Central Science (edisi ke-9). New Jersey: Prentice Hall. ISBN 0-13-066997-0.
- ^ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (edisi ke-4). Upper Saddle River, New Jersey: Pearson Prentice Hall. hlm. 37.
- ^ M. M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. hlm. 59.
- ^ “Official SI Unit definitions”. Bipm.org. Diakses tanggal 2011-06-12.
- ^ Burrows et al. 2009, hlm. 16.
- ^ Atkins & de Paula 2009, hlm. 9.
- ^ Reilly, Michael. (2007). Mechanical force induces chemical reaction, NewScientist.com news service, Reilly
- ^ Chemical Reaction Equation– IUPAC Goldbook
- ^ Gold Book Chemical Reaction IUPAC Goldbook
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2007–2008). “Elemental Chemistry” (PDF). usouthal.edu.
- ^ University of Colorado Boulder (November 21, 2013). “Atoms and Elements, Isotopes and Ions”. colorado.edu.
- ^ Paik, Seoung-Hey (2015). “Understanding the Relationship Among Arrhenius, Brønsted–Lowry, and Lewis Theories”. Journal of Chemical Education (dalam bahasa Inggris). 92 (9): 1484–1489. Bibcode:2015JChEd..92.1484P. doi:10.1021/ed500891w.
- ^ Brönsted, J.N. (1923). “Einige Bemerkungen über den Begriff der Säuren und Basen” [Some observations about the concept of acids and bases]. Recueil des Travaux Chimiques des Pays-Bas. 42 (8): 718–728.
- ^ Lowry, T.M. (1923). “The uniqueness of hydrogen”. Journal of the Society of Chemical Industry. 42 (3): 43–47.
- ^ Miessler & Tarr 1991, hlm. 166
- ^ Miessler & Tarr 1991, hlm. 170–172
- ^ “History of Acidity”. Bbc.co.uk. 2004-05-27. Diakses tanggal 2011-06-12.
- ^ “Redox Reactions”. wiley.com. Diarsipkan dari versi asli tanggal 2012-05-30. Diakses tanggal 2012-05-09.
Daftar pustaka[sunting | sunting sumber]
- Atkins, Peter; de Paula, Julio (2009) [1992]. Elements of Physical Chemistry (dalam bahasa Inggris) (edisi ke-5). New York: Oxford University Press. ISBN 978-0-19-922672-6.
- Burrows, Andrew; Holman, John; Parsons, Andrew; Pilling, Gwen; Price, Gareth (2009). Chemistry3 (dalam bahasa Inggris). Italia: Oxford University Press. ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Inorganic Chemistry (dalam bahasa Inggris) (edisi ke-3). Harlow, Essex: Pearson Education. ISBN 978-0-13-175553-6.
- Miessler, G.L.; Tarr, D.A. (1991). Inorganic Chemistry (dalam bahasa Inggris) (edisi ke-3). Upper Saddle River, NJ: Prentice Hall. ISBN 978-0-13-465659-5.
Bacaan lebih lanjut[sunting | sunting sumber]
- Atkins, P. W. (2003). Galileo’s Finger: The Ten Great Ideas of Science (dalam bahasa Inggris). Oxford University Press. ISBN 0-19-860941-8.
- Atkins, P. W. Physical Chemistry (dalam bahasa Inggris). Oxford University Press. ISBN 0-19-879285-9.
- Atkins, P. W.; et al. (1983). Molecular Quantum Mechanics (dalam bahasa Inggris). Oxford University Press.
- Atkins, P. W.; Overton, T.; Rourke, J.; Weller, M.; Armstrong, F. (2006). Shriver and Atkins Inorganic Chemistry (dalam bahasa Inggris) (edisi ke-4). Oxford University Press. ISBN 0-19-926463-5.
- Chang, Raymond (1998). James M. Smith, ed. Chemistry (dalam bahasa Inggris) (edisi ke-6). Boston. ISBN 0-07-115221-0.
- Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. (2000). Organic Chemistry (dalam bahasa Inggris). Oxford University Press. ISBN 0-19-850346-6.
- McWeeny, R. Coulson’s Valence (dalam bahasa Inggris). Oxford Science Publications. ISBN 0-19-855144-4.
- Pauling, L. (1988). General Chemistry (dalam bahasa Inggris). Dover Publications. ISBN 0-486-65622-5.
- Pauling, L. (1960). The Nature of the chemical bond (dalam bahasa Inggris). Cornell University Press. ISBN 0-8014-0333-2.
- Pauling, L.; Wilson, E. B. Introduction to Quantum Mechanics with Applications to Chemistry (dalam bahasa Inggris). Dover Publications. ISBN 0-486-64871-0.
- Smart and Moore (1992). Solid State Chemistry: An Introduction (dalam bahasa Inggris). Chapman and Hall. ISBN 0-412-40040-5.
- Stephenson, G. Mathematical Methods for Science Students (dalam bahasa Inggris). Longman. ISBN 0-582-44416-0.
- Voet and Voet (1995). Biochemistry (dalam bahasa Inggris). Wiley. ISBN 0-471-58651-X.
Pranala luar[sunting | sunting sumber]

Wikibooks memiliki buku di:

Wikibooks memiliki buku di:
Subjek:Kimia/Materi:Asam, Basa dan Garam
- (Indonesia) chem-is-try.org Diarsipkan 2004-08-26 di Wayback Machine. – Situs Web Kimia Indonesia
- (Indonesia) Portal kimianet LIPI
- (Inggris) Buku teks kimia umum di Wikibooks
- (Inggris) Tata nama IUPAC, lihat terutama bagian “Gold Book” yang memuat definisi istilah-istilah kimia
- (Inggris) Data keamanan berbagai bahan kimia (MSDS) Diarsipkan 2007-10-16 di Wayback Machine.
